細胞死制御因子による生体の恒常性維持機構の解明を目指して
発生過程において制御された細胞死であるアポトーシスが生じることで、正常な発生が誘導されることが知られており、アポトーシスの異常は自己免疫疾患やがんなどに関与していることも示されています。また最近の研究では制御された細胞死(特定の遺伝子の機能により制御された細胞死)の中にはアポトーシスだけではなく、ネクロプトーシス、パイロトーシスやフェロプトーシスなどの細胞死が存在することが分子レベルで明らかにされ、心筋梗塞や脳梗塞時の傷害や、ウイルス感染の防御に関連していることがわかってきました。(詳細はラボのホームページのエッセイ参照, http://tohobiochemi.jp/essay/index.html)
私達は、これまでTNFなどにより活性化される転写因子NF-κBの活性化のメカニズムの研究を行ってきました(Nakano et al, J Biol Chem 1996, PNAS 1998, PNAS 1999;)。NF-κBはリンパ節の発生や、炎症応答、細胞生存に必須の転写因子です。そのNF-κBによる細胞死の抑制のメカニズムを解析する過程で、NF-κBはcellular FLICE-inhibitory protein (cFLIP)と呼ばれる細胞死抑制因子のタンパク質の安定性を保ち、引き続いて起こる活性酸素産生や持続するMAPキナーゼの活性化を抑制することで、細胞死を抑制していることを見出しました (Sakon et al, EMBO J 2003; Nakajima et al, EMBO J 2006; Nakajima et al, Oncogene 2008)。このように私たちは、細胞の生と死という運命決定機構のメカニズムと、細胞死後に誘導される生体応答に興味をもち研究を続けてきています。現在の研究室の主なテーマは大きく2つあります。
1)細胞死制御に関わる様々な遺伝子改変マウスを用いて様々な病態における細胞死の役割の解明すること。
2)細胞死の実行因子や細胞死に伴い放出されるDAMPs(Danger-associated molecular patterns)と呼ばれる分子種を最先端の技術を用いてイメージング(細胞を生きたまま観察すること)することで、これらの現象の根底にある原理を解明すること。
遺伝子改変マウスを用いた解析
- 1) 組織恒常性維持におけるcFLIPの役割の解明
cFLIP遺伝子を腸上皮細胞や肝細胞だけで特異的に発現を無くしたマウスを作製し、その表現型を解析しました。それぞれの組織特異的なcFLIP欠損マウスは生後1~2日以内にほぼ全個体が死亡するということが判明しました(図1)。さらにこの時腸上皮細胞や肝細胞にはアポトーシスだけではなく、ネクロプトーシスが誘導されていることを電子顕微鏡の観察により明らかにしました。このことからcFLIPと呼ばれる遺伝子はアポトーシスやネクロプトーシスをブロックすることで、腸管や肝臓の恒常性維持に必須の役割を果たしていることが明らかになりました(Piao et al, Sci Signal 2012)。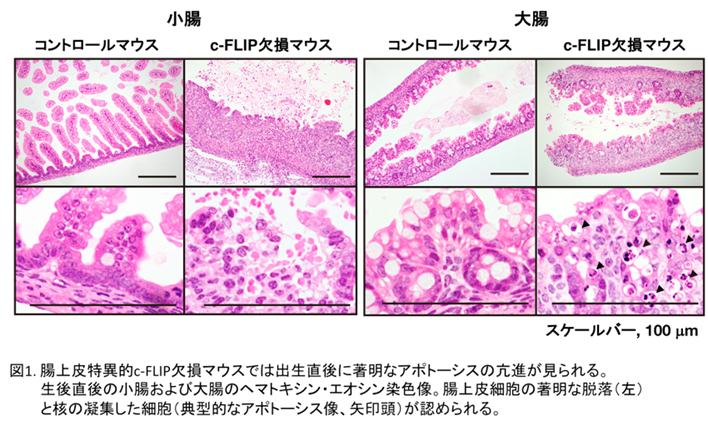
- 2) 肝死細胞除去における骨髄由来細胞の役割の検討
肝細胞でcFLIPの発現の低下したマウス(完全に消失させると出生直後に致死となるため)を用いて、肝死細胞の除去に関与する細胞の検討を行いました。
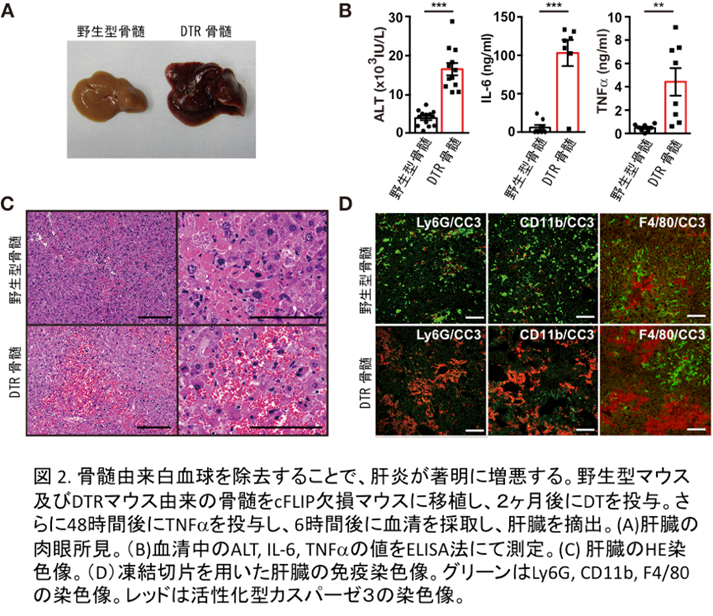
予想外なことに肝臓に常在するクッパー細胞を除去しても肝死細胞の除去には何ら影響を与えなかったかったものの、骨髄から浸潤してくる単球や好中球を除去したところ、肝炎が劇症化し、アポトーシスに陥った肝細胞から大量のヒストンH3が血中に放出され、さらに放出されたヒストンが血管内皮障害に関与しているという現象を見出しました(図2)。このことはヒトの劇症肝炎などでも血中に大量のヒストンH3が放出されている可能性を示しており、ヒストンH3の毒性を中和するような方法が、劇症肝炎の新しい治療法となる可能性を示しています(Piao et al, Hepatology 2017)。 - 3) 新生児期に生じる表皮分化障害のメカニズムの解明
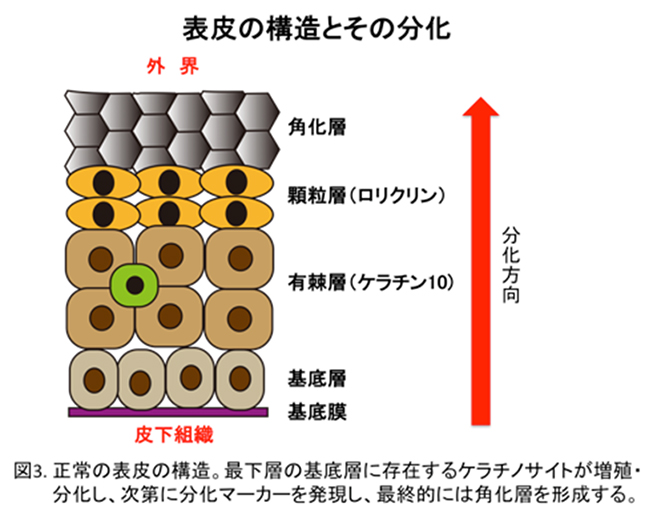
外部環境と体内を隔てる上皮の一つである表皮(皮膚)組織は、複数種類の細胞(上皮系細胞や免疫系細胞など)や細胞外成分(コラーゲンなど)の要素からなる多元的なバリアで構築されています(図3)。これらの上皮バリアは、単なる物理的障壁ではなく、免疫系と相まって細菌やウィルス、環境汚染物質の侵入を防御する一方、常在細菌叢による病原細菌の排除との相互作用で適正に維持されています。こうした統合的なバリア機構の破綻は、様々な疾患の原因になると考えられています。
cFLIPを表皮で欠損させるとこのマウスは子宮内ですでにケラチノサイトの細胞死が大量に起こり、生まれる前に死ぬことがわかりました。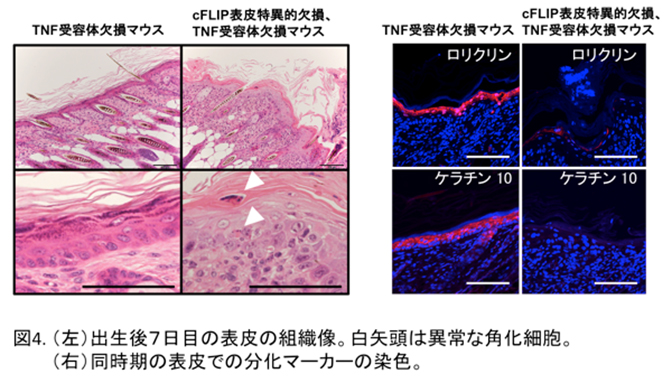
そこでTNFによるケラチノサイトの細胞死を阻止するためにTNFの受容体の欠損マウスと交配したところ、子宮内での死亡を防ぐことができ、外見上は正常なマウスとして生まれてきました。しかし、生まれて5日目頃から「かさぶた」を伴う皮膚炎が発病し、生後6〜7日以内にすべてのマウスが死亡しました。このマウスの表皮からは大量の水分が蒸発しており、皮膚バリア機能が顕著に低下していることが示されました。また、ケラチノサイトの細胞死が亢進すると同時に細胞増殖も亢進し、成熟表皮の分化マーカーの著しい発現低下が見られました(図4)。 すなわち、このマウスの表皮においても、乾癬やアトピー性皮膚炎のような、表皮バリア機構の破綻による重篤な皮膚炎を生じたということになります。このマウスでどのようなメカニズムで表皮の分化が障害されているかを明らかにするために、出生直後のマウスから表皮由来のケラチノサイトを採取し、培養実験を行いました。ここで驚くことにcFLIP欠損マウスから調整したケラチノサイトも通常のマウスと同じように分化が誘導されました。このことはcFLIP欠損マウスの生体で見られる分化障害は、細胞自身の問題が原因ではないことを示しています。そこで、皮膚炎を生じた表皮組織で発現の高かったIL-6やIL-17Aといった炎症性サイトカインとともにケラチノサイトを培養したところ、表皮の分化マーカーの発現が顕著に低下することがわかりました。すなわち、cFLIP欠損マウスにおける表皮組織のバリア機能低下には、炎症性サイトカインの存在するケラチノサイトの微小環境が影響していることが明らかになりました(Piao et al, J Allergy Clin Immunol 2019)。 - 4) 肝細胞死亢進マウスを用いた肝幹細胞増殖因子同定
非アルコール性脂肪性肝炎(NASH)は飲酒歴がないにもかかわらず脂肪肝と慢性の炎症が進展し、最終的には肝がんを発症する疾患です。肝細胞でcFLIPの発現が低下したマウスにNASHモデルの一つであるコリン欠乏(CDE)食を投与したところ、著明に肝臓において慢性肝障害に伴う肝再生時に出現してくるliver progenitor cells (LPC)が増加するという現象を見出しています。現在この増殖因子の同定と、肝臓におけるトランスクリプトーム解析や血清を用いたメタボローム解析を行うことで、LPCの増殖に関与するサイトカインの同定や、NASHの予後や進行を予測できるようなバイオマーカーの同定を目指して研究を進めているところです。 - 5) cFLIPsトランスジェニックマウスの解析
ヒトcFLIPをコードする遺伝子(正式名称はCFLAR)はcFLIPLとcFLIPsの2種類のタンパク質を産生しますが、cFLIPLはアポトーシスもネクロプトーシスも抑制するのに対し、cFLIPsはアポトーシスを抑制するものの、ネクロプトーシスを促進することが他のグループより報告され、我々も同様の現象を見出しています。そこで、in vivoにおけるcFLIPsの役割を明らかにするために、cFLIPsを過剰に発現するトランスジェニック(Tg)マウスを樹立しました(兵庫医大 大村谷教授、熊本大学 荒木教授との共同研究)。cFLIPs Tgマウスは胎児期に重篤な小腸炎を発症し、予想外なことに小腸の上皮細胞は主にネクロプトーシスではなく、アポトーシスで死んでいることを見出しました。(図5)自然免疫系の3型自然リンパ球を除去することで腸炎が劇的に改善することから、この腸炎の増悪には3型自然リンパ球の産生するインターロイキン(IL)-22と呼ばれるサイトカインが重要な役割を果たしていることを見出しています。cFLIPs Tgマウスの腸炎モデルの病態を解析することで、ヒト新生未熟児が時に発症する壊死性腸炎を治療するための、新たな知見を得られるのではないかと考え解析しているところです(Shindo et al, iScience in press)。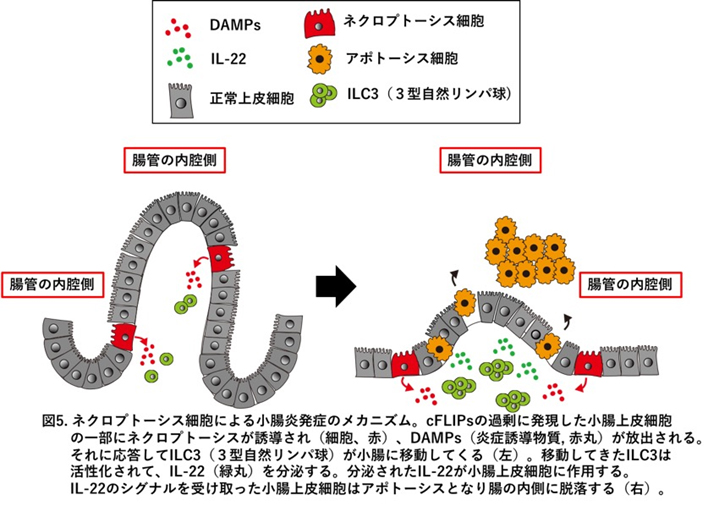
ネクロプトーシスのライブセルイメージング
細胞死の進行を生きた培養細胞の細胞内で可視化(つまり細胞を殺したり破壊したりせずに、顕微鏡で実際に細胞死が進行しているかを観察すること)する技術の開発は、細胞死がどのような状況で起こっているのか、またその結果としてどのような反応を周囲の細胞に誘導するのかを解析する上で非常に重要です。これまでにアポトーシスについては、細胞死の進行時にカスパーゼと呼ばれる酵素が活性化することを利用して、FRET(Forester Resonance Energy Transfer)と呼ばれる技術を用いて可視化することに共同研究者の三浦教授らが成功していました。しかし、ネクロプトーシスの場合には、カスパーゼのようなタンパク質分解酵素が活性化しないために、同様の方法でイメージングすることは不可能であり、可視化における大きな障壁がネクロプトーシス研究のボトルネックとなっていました。
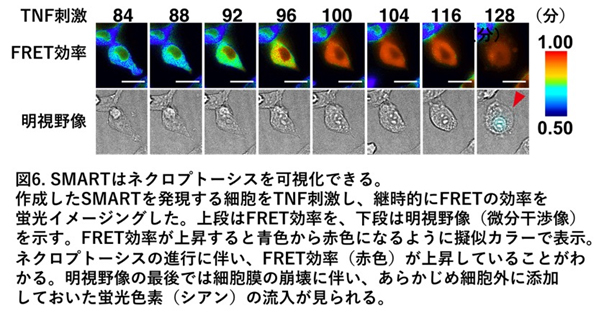
今回私たちのグループは、ネクロプトーシスが誘導される際に細胞膜障害を誘導する分子であるMLKLという分子を利用してFRET用のセンサータンパク質を作成し、世界で初めてネクロプトーシスの様子を蛍光イメージングする技術を開発しました。ネクロプトーシス誘導時にMLKL分子に起こる構造変化に合わせてFRET反応が起こるように蛍光タンパク質と組み合わせ、マウスやヒトの細胞でTNFなどの刺激によりネクロプトーシスが誘導された際にネクロプトーシスの誘導の様子をリアルタイムで可視化できるセンサータンパク質を開発することに成功しました(図6)
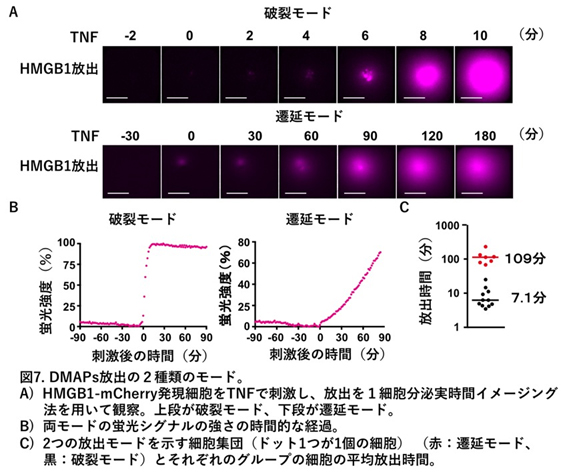
cFLIP分解のメカニズムの解明
cFLIPタンパク質は不安定であり、プロテアソームにより分解されることが明らかとなっていますが、その分解に関与するE3リガーゼはこれまで、ITCHと呼ばれている酵素だと考えられてきました。しかし、我々はその他の酵素の存在も十分考えられることから、独自にその他の酵素の機能解析も進めており、最近新しいリガーゼの同定に成功しました。現在この分子を欠損した細胞を樹立するとTNF刺激によるアポトーシスが亢進することを見出しており、この分子の解析を行なっているところです。
酸化ストレスによる生体応答制御
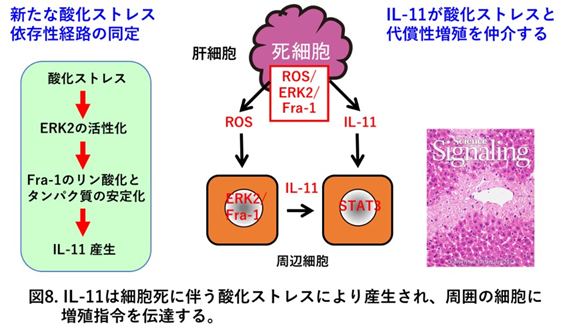
活性酸素種(ROS)の産生亢進による酸化ストレスは、これまで単なる生体機能を障害する有害なものとして考えられてきましたが、現在では様々な生体応答に有益な役割も担っていることが明らかとなってきました。例えば、好中球などで産生されるROSは貪食したバクテリアの殺菌に重要な役割を果たしています。一方、 増殖因子などの刺激に伴い産生されるROSはMAPキナーゼなどの活性化を誘導して、細胞内に特異的な信号を発信してすることで細胞の機能を調節していることも明らかとなってきました。加えて、私達のグループは酸化ストレス依存性に産生誘導される遺伝子群を網羅的に解析する過程で、 誘導される分子のひとつとしてインターロイキン11と呼ばれるサイトカインを同定しました。そして解析の結果、このサイトカインが死んだ肝細胞から酸化ストレス依存性に産生・放出され、細胞増殖に関与していることを初めて明らかにしました (Nishina et al, Sci Signal 2012)(図8)。そこで我々は、生化学的手法、分子生物学的手法ならびに遺伝学的手法をもちいて産生機構を明らかにするだけでなく、IL-11を産生する細胞を光らせるようなマウス(IL-11 GFPレポーターマウス)の作製をすることで組織学的解析、イメージング技術を用いて、IL-11の生体の恒常性維持やIL-11産生細胞の発がんへの関与を明らかにしていきたいと思っています。
代表論文
- 1. Nishina T, Deguchi Y, Ohshima D, Takeda W, Ohtsuka M, Shichino S, Ueha S, Yamazaki S, Kawauchi M, Nakamura E, Nishiyama C, Kojima Y, Adachi-Akahane S, Hasegawa M, Nakayama M, Oshima M, Yagita H, Shibuya K, Mikami T, Inohara N, Matsushima K, Tada N, Nakano H. Interleukin-11-expressing fibroblasts have a unique gene signature correlated with poor prognosis of colorectal cancer.Nat Commun 2021;12:2281.
- 2. Nakabayashi O, Takahashi H, Moriwaki K, Komazawa-Sakon S, Ohtake F, Murai S, Tsuchiya Y, Koyahara Y, Saeki Y, Yoshida Y, Yamazaki S, Tokunaga F, Sawasaki T, Nakano H. MIND bomb 2 prevents RIPK1 kinase activity-dependent and -independent apoptosis through ubiquitylation of cFLIPL. Commun Biol 2021;4.
- 3. Shindo R, Ohmuraya M, Komazawa-Sakon S, Miyake S, Deguchi Y, Yamazaki S, Nishina T, Yoshimoto T, Kakuta S, Koike M, Uchiyama Y, Konishi H, Kiyama H, Mikami T, Moriwaki K, Araki K, Nakano H. Necroptosis of Intestinal Epithelial Cells Induces Type 3 Innate Lymphoid Cell-Dependent Lethal Ileitis. iScience 2019;15:536-551.
- 4. Piao X, Miura R, Miyake S, Komazawa-Sakon S, Koike M, Shindo R, Takeda J, Hasegawa A, Abe R, Nishiyama C, Mikami T, Yagita H, Uchiyama Y, Nakano H. Blockade of TNF receptor superfamily 1 (TNFR1)-dependent and TNFR1-independent cell death is crucial for normal epidermal differentiation. J Allergy Clin Immunol 2019;143:213-228 e210.
- 5. Murai S, Yamaguchi Y, Shirasaki Y, Yamagishi M, Shindo R, Hildebrand JM, Miura R, Nakabayashi O, Totsuka M, Tomida T, Adachi-Akahane S, Uemura S, Silke J, Yagita H, Miura M, Nakano H. A FRET biosensor for necroptosis uncovers two different modes of the release of DAMPs. Nat Commun 2018;9:4457.
- 6. Piao X, Yamazaki S, Komazawa-Sakon S, Miyake S, Nakabayashi O, Kurosawa T, Mikami T, Tanaka M, Van Rooijen N, Ohmuraya M, Oikawa A, Kojima Y, Kakuta S, Uchiyama Y, Tanaka M, Nakano H. Depletion of myeloid cells exacerbates hepatitis and induces an aberrant increase in histone H3 in mouse serum. Hepatology 2017;65:237-252.
- 7. Piao X, Komazawa-Sakon S, Nishina T, Koike M, Piao JH, Ehlken H, Kurihara H, Hara M, Van Rooijen N, Schutz G, Ohmuraya M, Uchiyama Y, Yagita H, Okumura K, He YW, Nakano H. c-FLIP Maintains Tissue Homeostasis by Preventing Apoptosis and Programmed Necrosis. Sci Signal 2012;5:ra93.
- 8. Nishina T, Komazawa-Sakon S, Yanaka S, Piao X, Zheng DM, Piao JH, Kojima Y, Yamashina S, Sano E, Putoczki T, Doi T, Ueno T, Ezaki J, Ushio H, Ernst M, Tsumoto K, Okumura K, Nakano H. Interleukin-11 links oxidative stress and compensatory proliferation. Sci Signal 2012;5:ra5.
- 9. Ushio H, Ueno T, Kojima Y, Komatsu M, Tanaka S, Yamamoto A, Ichimura Y, Ezaki J, Nishida K, Komazawa-Sakon S, Niyonsaba F, Ishii T, Yanagawa T, Kominami E, Ogawa H, Okumura K, Nakano H. Crucial role for autophagy in degranulation of mast cells. J Allergy Clin Immunol 2011;127:1267-1276 e1266.
- 10. Tokunaga F, Nakagawa T, Nakahara M, Saeki Y, Taniguchi M, Sakata S, Tanaka K, Nakano H, Iwai K. SHARPIN is a component of the NF-kappaB-activating linear ubiquitin chain assembly complex. Nature 2011;471:633-636.
- 11. Nakajima A, Komazawa-Sakon S, Takekawa M, Sasazuki T, Yeh WC, Yagita H, Okumura K, Nakano H. An antiapoptotic protein, c-FLIP(L), directly binds to MKK7 and inhibits the JNK pathway. EMBO J 2006;25:5549-5559.
- 12. Sakon S, Xue X, Takekawa M, Sasazuki T, Okazaki T, Kojima Y, Piao JH, Yagita H, Okumura K, Doi T, Nakano H. NF-kappaB inhibits TNF-induced accumulation of ROS that mediate prolonged MAPK activation and necrotic cell death. EMBO J 2003;22:3898-3909.
- 13. Nakano H, Sakon S, Koseki H, Takemori T, Tada K, Matsumoto M, Munechika E, Sakai T, Shirasawa T, Akiba H, Kobata T, Santee SM, Ware CF, Rennert PD, Taniguchi M, Yagita H, Okumura K. Targeted disruption of Traf5 gene causes defects in CD40- and CD27-mediated lymphocyte activation. Proc Natl Acad Sci U S A 1999;96:9803-9808.
- 14. Nakano H, Shindo M, Sakon S, Nishinaka S, Mihara M, Yagita H, Okumura K. Differential regulation of IkappaB kinase alpha and beta by two upstream kinases, NF-kappaB-inducing kinase and mitogen-activated protein kinase/ERK kinase kinase-1. Proc Natl Acad Sci U S A 1998;95:3537-3542.
- 15. Nakano H, Oshima H, Chung W, Williams-Abbott L, Ware CF, Yagita H, Okumura K. TRAF5, an activator of NF-kappaB and putative signal transducer for the lymphotoxin-beta receptor. J Biol Chem 1996;271:14661-14664.
総 説
- 1. Nakano H, Piao X, Shindo R, Komazawa-Sakon S. Cellular FLICE-Inhibitory Protein Regulates Tissue Homeostasis. Curr Top Microbiol Immunol 2017;403:119-141.
- 2. Tsuchiya Y, Nakabayashi O, Nakano H. FLIP the Switch: Regulation of Apoptosis and Necroptosis by cFLIP. Int J Mol Sci 2015;16:30321-30341.
- 3. Nakano H, Nakajima A, Sakon-Komazawa S, Piao JH, Xue X, Okumura K. Reactive oxygen species mediate crosstalk between NF-kappaB and JNK. Cell Death Differ 2006;13:730-737.
- 4. Nakano H. Signaling crosstalk between NF-kappaB and JNK. Trends Immunol 2004;25:402-405.